キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。1 キレート滴定法の原理 2 指示薬の性質 3 器具の構造と規定 (中和の場合は、pH 読み取り、滴定後の使用量を求める(jis k 0050 附属書 cキレート滴定では、pH の設定に注意を払う必要がある。 まず EDTA が直接的にキレート生成にかかわるのは四価の負イオンとしてであるが、pH が低くなると四価の負イオンとして溶存する量が減少し、キレート生成が押さえられるようになる。

エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
キレート滴定 ph10
キレート滴定 ph10-キレート 滴定法で土壌中のカルシウム濃度が簡便に測定する ことが確認できたので,今後サンプル数を増やして データを取得していきたい。 3.結論 ①本実験では二酸化炭素を添加した水への炭酸カル シウムの溶解度が大きくなることがキレート滴定に目次 キレート滴定の手法 キレート滴定にもちいられる試薬 キレート滴定法における選択性 キレート滴定に常用される試薬類 金属イオンの滴定法 陰イオンおよび有機化合物の分析への応用 「BOOKデータベース」 より




酢酸のphを計算できますか 平衡定数を用いた計算方法をわかりやすく解説 ジグザグ科学 Com
*滴定終点判定法は次週に解説する 9 キレート滴定の滴定曲線 (p68, 図216) EDTA標準液 金属イオン溶液 pM pM = log M pM = 10 なら M = 1010 mol/L 10 条件付錯生成定数K f'= ML n M' L'n 錯体生成平衡はpH の影響を受ける(p) pHが高くなると・・・ 錯体が(pH 7 ~ 11) 3 EBT 指示薬を用いるキレート滴定 pH 7~11 の緩衝液を用いる →指示薬のイオン色は青色(HIn2)である 指示薬イオン(HIn2)と金属イオン(M2)が共存すると・・・ HIn2 M2 ⇌MIn H 指示薬キレート(MIn)の赤色に変色(a)滴定しようとする金属イオンに対し、鋭敏に変色する金属指示薬のない 場合。 (b)補助キレート剤を用いても、滴定可能なpH限域内で、目的の金属イオン が水酸化物として沈殿し、金属イオンを溶液として保つことが不可能な場合。
よって、 (1)の結果と合わせると、 Cd 2のキレート滴定の 至適 pH 範囲 は、 40 <pH <78 となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる! XIII13 補助錯化剤キレート滴定(キレートてきてい、chelatometric titration )とは、錯滴定の一種で、錯形成試薬としてキレート試薬と呼ばれる多座配位子を用いるもの。 この容量分析法は金属 イオンの迅速で簡単な定量法の1つとして広く用いられている。 主なキレート試薬としてEDTA(エチレンジアミン四酢酸1704 · <化学>キレート滴定関連で質問です。 滴下する溶液に、kohを加えるのですが、phを高くする為に使用する。という事ですが、どんな作用で何でその必要があるんですか? また遮蔽剤とは何のことでしょう? 化学的理
Q pH指示薬変色範囲 A 組織染色や酸塩基指示薬、キレート滴定指示薬などとして、よく使われる染色剤の変色範囲を以下にまとめました。 pHとは 水溶液の酸性、アルカリ性の性質を表す単位です。 酸性やアルカリの物質に含まれる水素イオン(Hホールピペットを用いて,Mg 2 を含む試水10 mLを100 mLビーカーに取る. 緩衝液(Na 2 B 4 O 7 ‐Na 2 CO 3, pH 10) 2 mLをメートルグラスで測り取り,加える. · 至急お願いします!!!キレート滴定の実験の課題で、「キレート滴定では、緩衝液を加えて液のphを一定に保っている。なぜphを一定に保つ必要があるか、理由を述べなさい。」とあるので すが、調べてもあまり出ていなくてわかりません!教えてくださいΣ(゚д゚lll) エチレンジアミン四




07 号 キレート剤の測定方法およびキレート剤の測定キット Astamuse
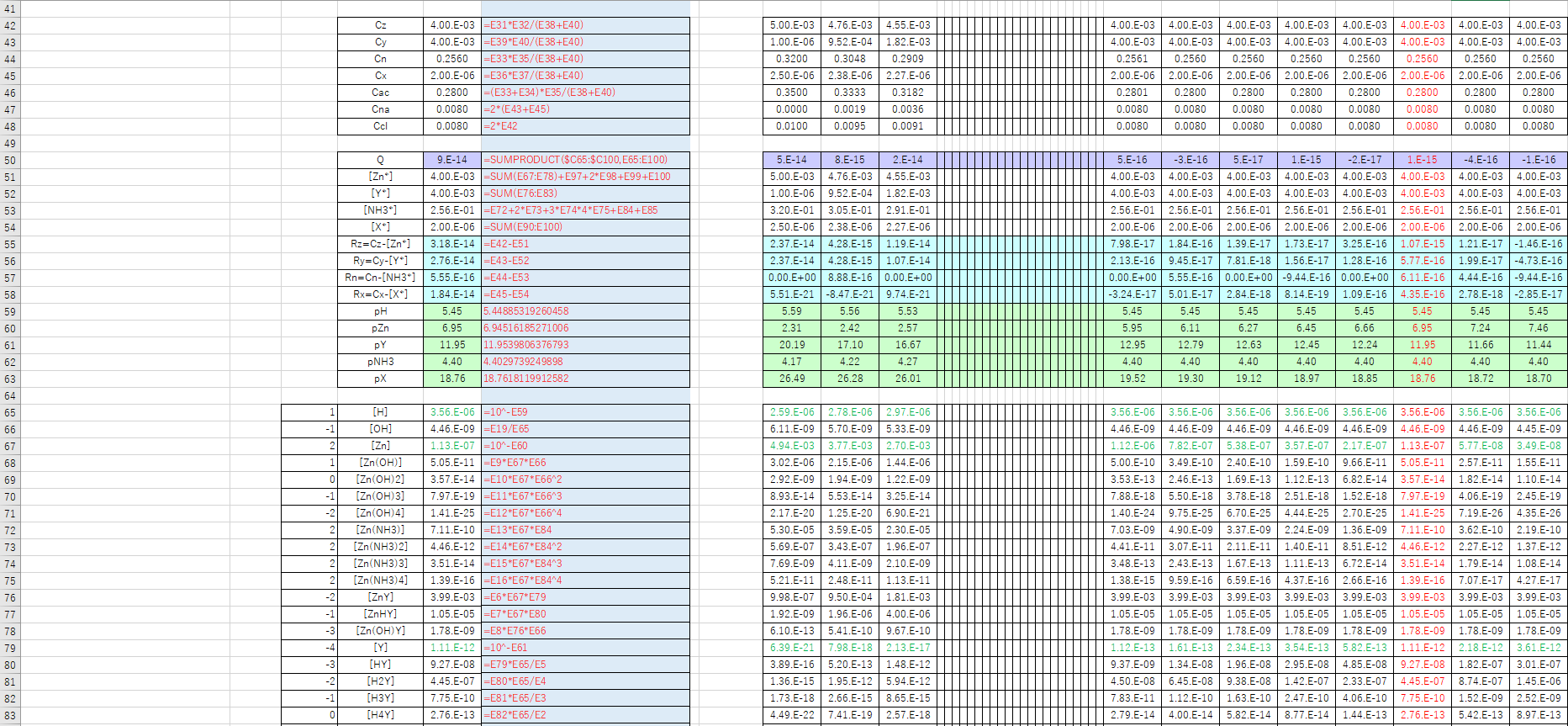



Edta 滴定曲線 溶解度などーエクセルを用いて
0511 · キレート滴定 キレート滴定とは、溶液中の特定の金属イオン濃度を調べることができる容量分析法です。以下のイメージ図を用いて、キレート滴定の概要を説明します。 キレート滴定における呈色の変化(イメージ図)アンモニア緩衝液 塩基性側にpHを調整 トリエタノールアミン キレート滴定の妨害イオンのマスキング(特にAlやFe) BT指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) EDTA溶液 滴定剤 使用する試薬・溶液 有機廃液タンクへ4.錯化合物とキレート滴定 41 配位結合とは何か 42 配位子の種類とキレート配位子 43 錯形成反応に対するph効果 44 キレート滴定の条件とph 45 edtaおよびntaによるキレート滴定の条件 46 金属指示薬とは何か 47 キレート滴定の種類
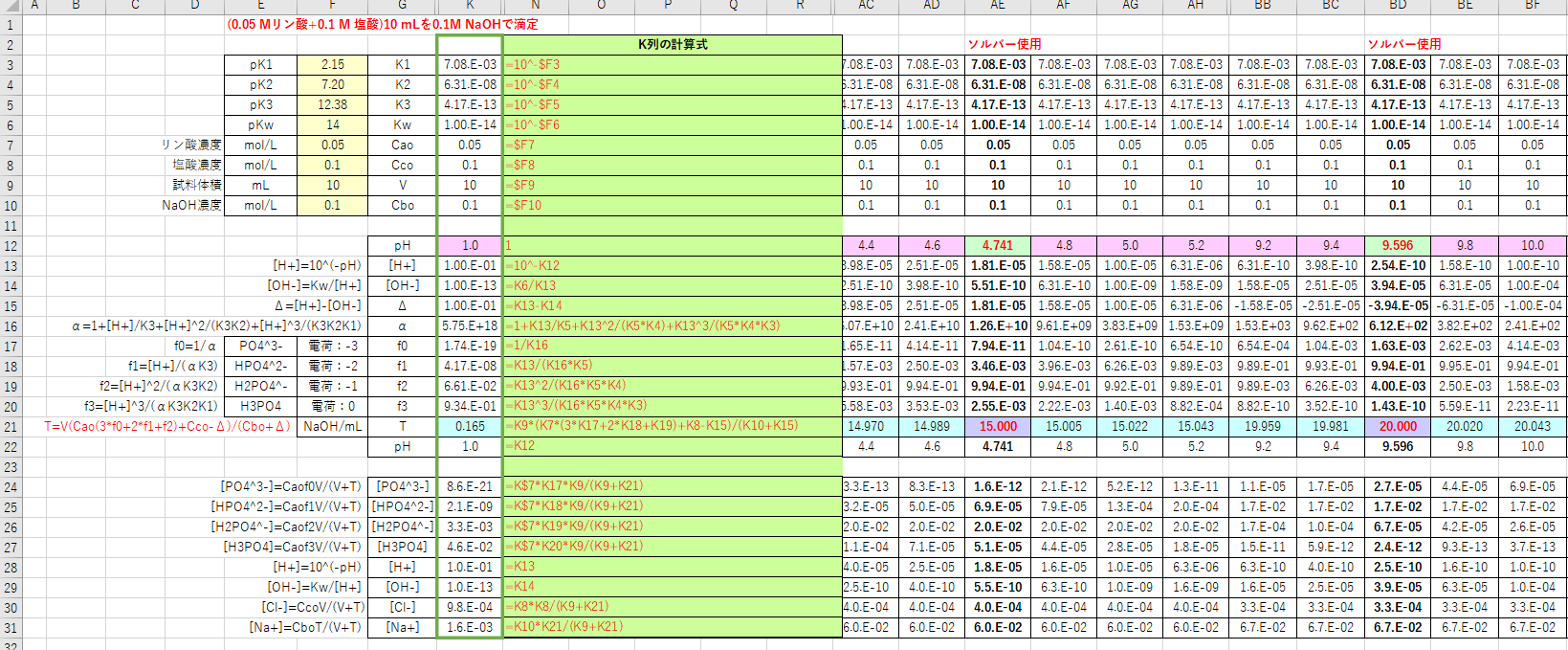



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




Edta キレート エチレンジアミン四酢酸 Edta
目次 キレート滴定の手法 キレート滴定にもちいられる試薬 キレート滴定法における選択性 キレート滴定に常用される試薬類 金属イオンの滴定法 陰イオンおよび有機化合物の分析への応用 「BOOKデータベース」 より1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。 また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。 2.原理 金属イオンに配位し、キレート化合物を形成する多座配位子をキレート試薬と呼ぶ。キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学




標準緩衝液 フタル酸塩ph標準液 Ph 4 01 25 Buffer Solution Standard Phthalate Ph Standard Solution Ph4 01 25 Degrees C 028 詳細情報 試薬 富士フイルム和光純薬




エチレンジアミン四酢酸 Edta の性質とキレート滴定について解説 ジグザグ科学 Com
試料の温泉水を精確に5倍に希釈し、まずカルシウムとマグネシウムの合量をph 10程度でedtaによるキレート滴定で定量する。 次に、試料に水酸化カリウムを加えpH1213 として滴定する。キレート滴定ではpH により試料と滴定試薬との反応性が変化するため、pH 調節は規定通り に行ってください。 光度センサーは純水で十分に洗浄後、水分を除去した状態で保管してください。 本体 : 電位差自動滴定装置(光度滴定用プリアンプリファイア PTA)キレート滴定の原理図拡大 pH12~13において、Mg 2+ は安定な水酸化物となってEDTAと反応しなくなるので、このpH領域で作用するNN指示薬を用いて Ca 2+ のみを定量することができる。




電位差自動滴定装置 メトロームジャパン株式会社 のカタログ無料ダウンロード 製造業向けカタログポータル Aperza Catalog アペルザカタログ




標準緩衝液 中性りん酸塩ph標準液 Ph6 86 25 Buffer Solution Standard Phosphate Ph Standard Equimolal Solution Ph6 86 25 Degrees C 025 詳細情報 試薬 富士フイルム和光純薬
ー ト滴定法は,エチレンジアミン四酢酸 (EDTA)及びその類縁体が,多くの金属イオンと価数に依らず1:1のキレート錯体 を形成することを利用した金属イオンの容量分析法である。 この方法は,主にCa2 +及びMg2+の滴定法(水の硬度の測定)として知 られさているが,適当な条件と金属指示薬の使用によって多くの金属イオンのmg/Lレベ ルでの定量が可能で水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターをモニア水1mlを いれるとその pH は11~12に なり,BのpHは4 で あるこ れに1%Na2SO4溶 液 1 mlを 加え,BaSO4の 沈殿の生ずる




薄めたmcilvaine緩衝液 Ph 6 8 Diluted Mcilvaine Buffer Solution Ph 6 8 041 049 詳細情報 医薬品 製造 品質管理 分析 試薬 富士フイルム和光純薬




18 号 溶液の分析方法 Astamuse
· 理由1:金属イオンとキレートが結合する強さ(安定度定数)は、pHによって変化する。 pHが低いほど結合は弱くなるので、できれば高pH域でやりたい。 理由2:しかし、金属イオンはpHが高くなると水酸化物の沈殿になり、キレート滴定できない。 水酸化物が出来ないpH領域でなければならない。 理由3:キレート剤は酸であり、金属イオンと結合する際②6 mL/L KOH溶液4 mL(pH=12ではマグネシウムは水酸化物Mg(OH)2になり、キレートを生成しない。)を加えてよく振り混ぜ、1分間放置する。 ③NN指示薬01 gを加え、EDTA標準溶液でNN指示薬の赤色が青色となり、赤みがなくなった時が終点である。3回の滴定の平均をとる。法法法法という。EDTAは水にほとんど溶けないので、キレート滴定では水に溶けやすいEDTA ・2Naを用いる。 全硬度の測定は、試料水のpHを約10 に調整した後,BT指示薬を加えて、EDTA溶洷 で滴定して求める。




メルカリ 薬剤師国家試験 領域別既出問題集 参考書 900 中古や未使用のフリマ




Ph 4 30 くえん酸ナトリウム緩衝液 5倍濃縮 生体試料用 Ph 4 30 Sodium Citrate Buffer Solution 198 詳細情報 分析 試薬 富士フイルム和光純薬
キレートメトリー(chelatometry),コンプレクソンメトリーともいう.水溶液中で金属イオンとキレート試薬とのキレート生成反応を利用して行う定量分析法で,終点の決定には金属指示薬,pH変化の測定,電位差法,光度法などがある.G Schwarzenbachらにより開発されたEDTA試薬による Ca 2+ ,Mg 2+ を滴定する方法は代表的なものである. · そこで、滴定の終点を見えるようにするため、 ebt(エリオクロムブラックt) などの指示薬を使用します。ebtを指示薬とした場合、 赤 → 青 となった時点を終点とできます ebtもキレート剤として働き、ca、mgなどと錯体を形成した際、赤色を示します。ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。




りん酸塩ph標準液 Phosphate Ph Standard Solution 166 詳細情報 分析 試薬 富士フイルム和光純薬
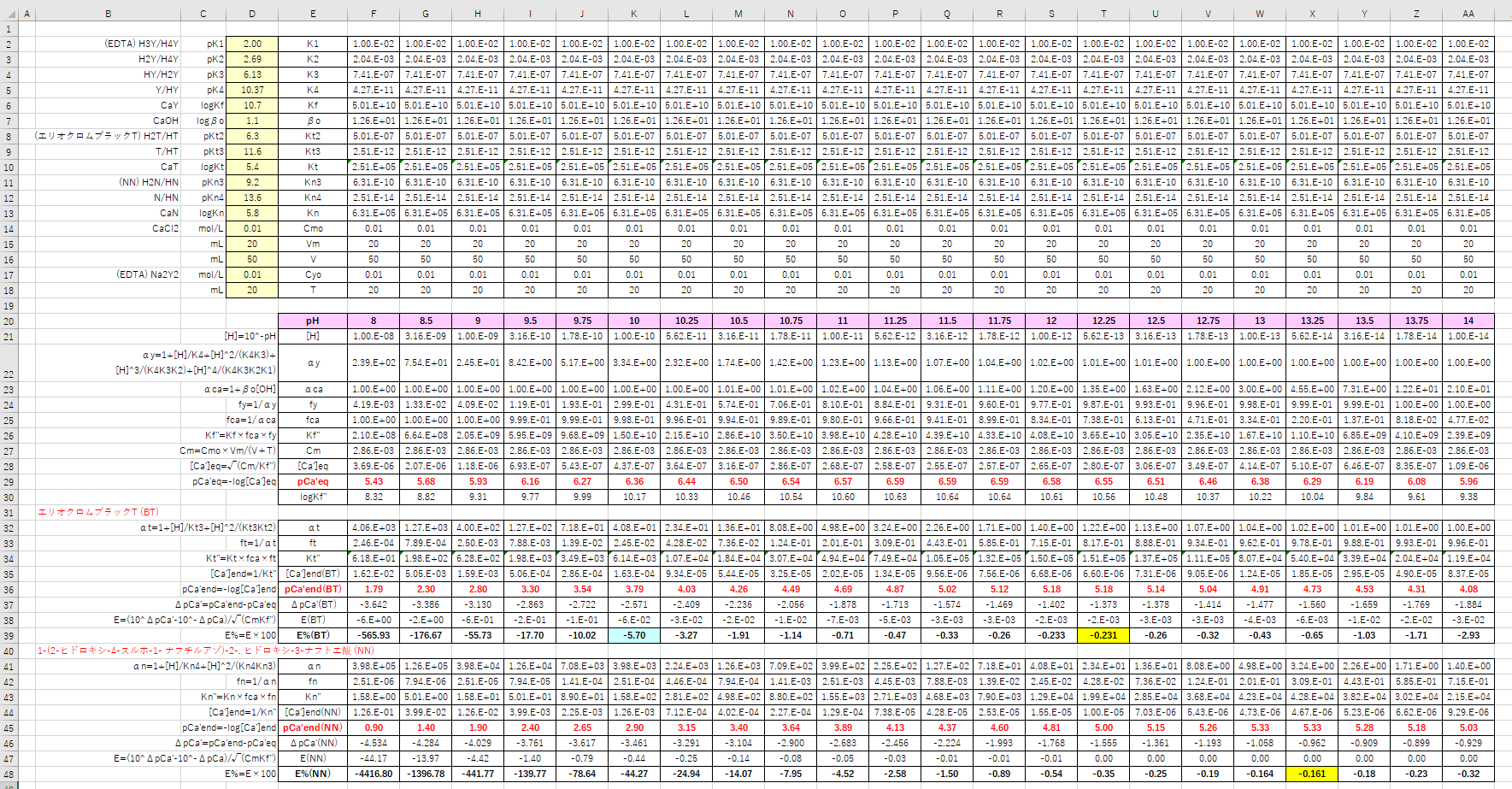



カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて
(2) 純度(滴定): 980% 以上 (3) 水溶状: 試験適合 (4) pH(25℃): 100〜1 (5) 強熱残分(硫酸塩): 600〜640%PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法




Mbaheblogjpxy1z 無料でダウンロード キレート滴定 Ph キレート滴定 Ph 理由
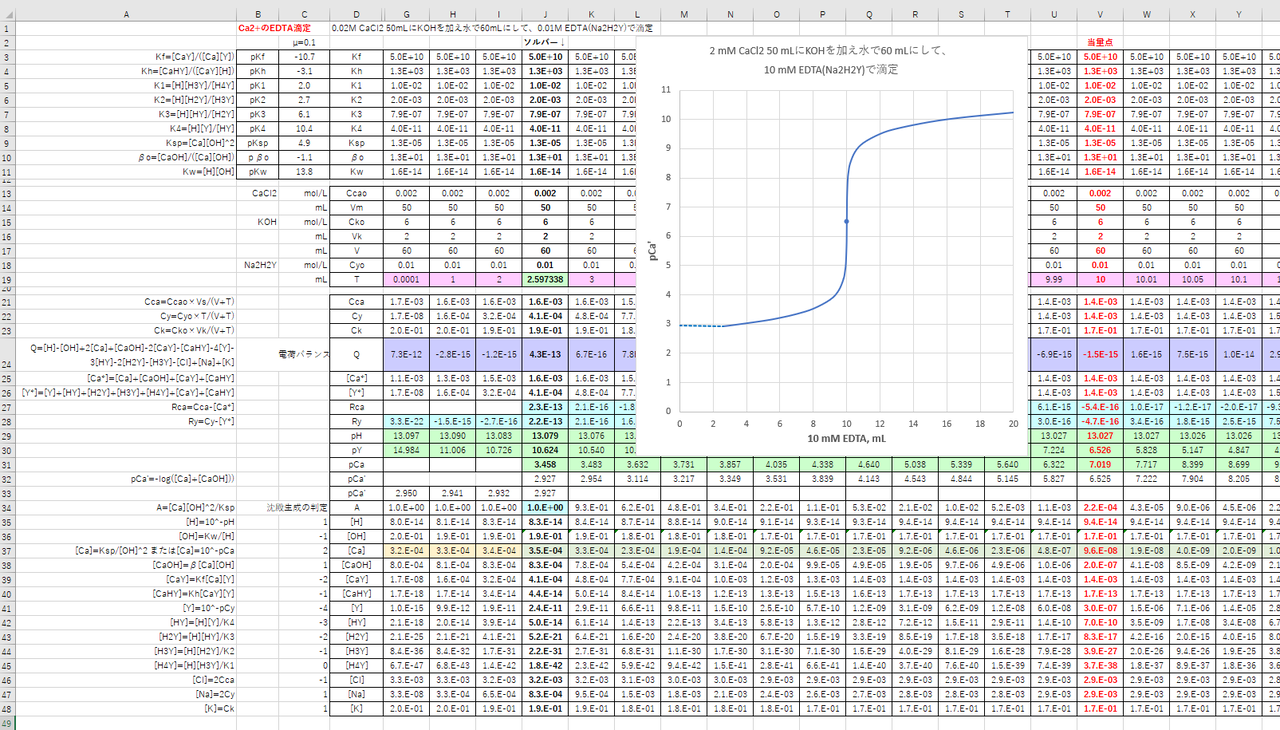



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて
PH 10 でキレート滴 定すると,pCaはEDTA溶液を50 mL滴下した当量点付近で急激に増大する。 この急激な変化を利用すると,滴定の終点を検出できる。pH 12 では更に大 * Ca2 = c Y = x と考える。 図62 0010 M EDTA による0010 M Ca2(50 mL)の滴定に及ぼすpH の影響B0673 受注時調製品 受注時調製品 分子式・分子量 NH4OHNH4Cl 物理的状態(℃) 液体 MDL番号 MFCDキレート滴定 濃度既知のca 0005m ca2溶液による水道水、ミネラルウォーターの硬度決定 実験日 5月9日金曜日 実験場所 1352材料設計学学生実験室 実験環境 天気:快晴 気温:8℃ 湿度:28% 目的 キレート滴定(edta法)により、edta溶液の濃度を決定し、edta法を用いて水道水、ミネラル




ヤフオク New薬品分析化学 第2版 化学的分析法の基礎と薬
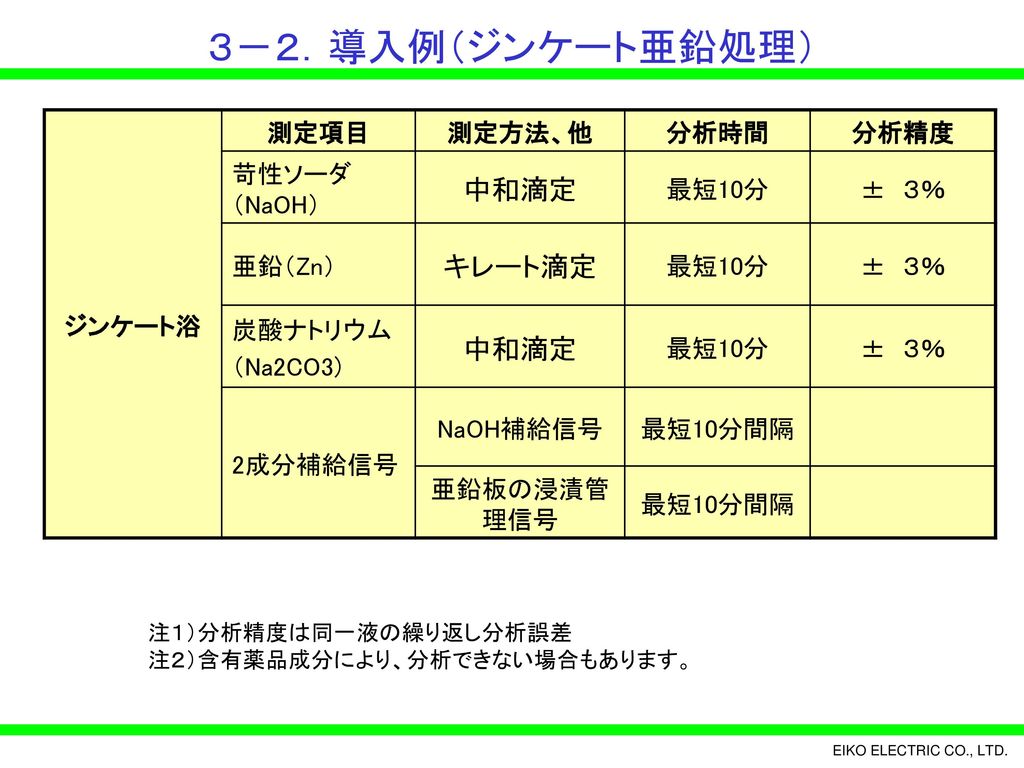



薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download
キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA 溶液のpHで変化する 温度が一定で分子形の溶解度は一定 溶液のpHにより変化しない 飽和溶液の上清の濃度 g/dL、mol/L pH46 th International Chemistry Olympiad Hanoi, Vietnam 14 Preparatory Problems 三種のイオンFe 3, Al3, Mg 2 を001 M から01 M の濃度範囲内に含む一つのサンプル溶 液を調製しなさい。 ステップ 2鉄鉄鉄鉄、、、、アルミニウムアルミニウム、、、マグネシウムイオン、マグネシウムイオンのののの滴定滴定




分析実務たん Jis準拠 数式を書くのが面倒なので手書きで




高速アミノ酸分析計用 Ph第3緩衝液 Buffer For High Speed Amino Acid Analyzer Ph 3 024 詳細情報 分析 試薬 富士フイルム和光純薬




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




1999 1017号 滴定制御方法 Astamuse




しゅう酸塩ph標準液 Oxalate Ph Standard Solution 151 詳細情報 分析 試薬 富士フイルム和光純薬




自動滴定装置 Gt 310 自動滴定装置 滴定計 日東精工アナリテック 旧社名 三菱ケミカルアナリテック




酢酸のphを計算できますか 平衡定数を用いた計算方法をわかりやすく解説 ジグザグ科学 Com




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog




17 号 可搬型滴定装置 Astamuse




1999 号 アミノ酸塩の製造方法 Astamuse
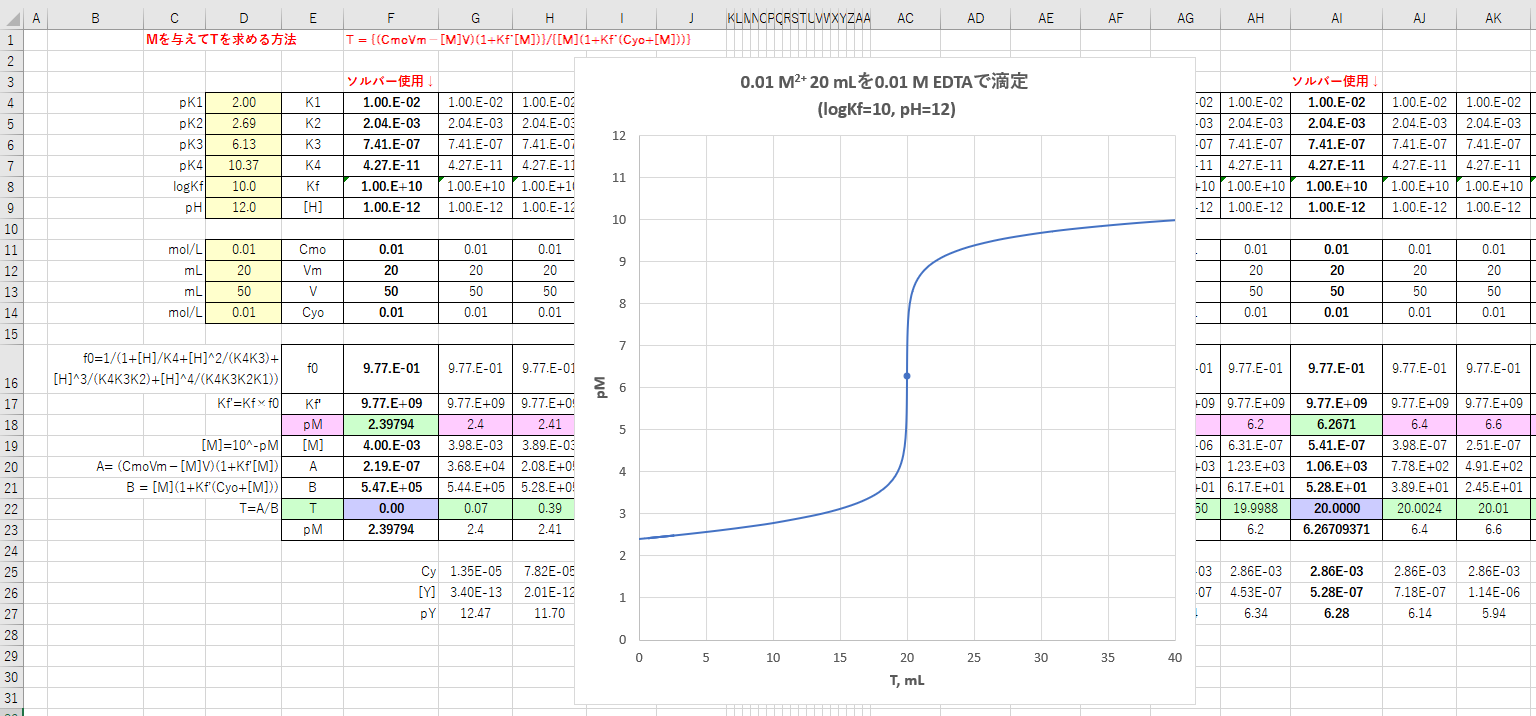



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて
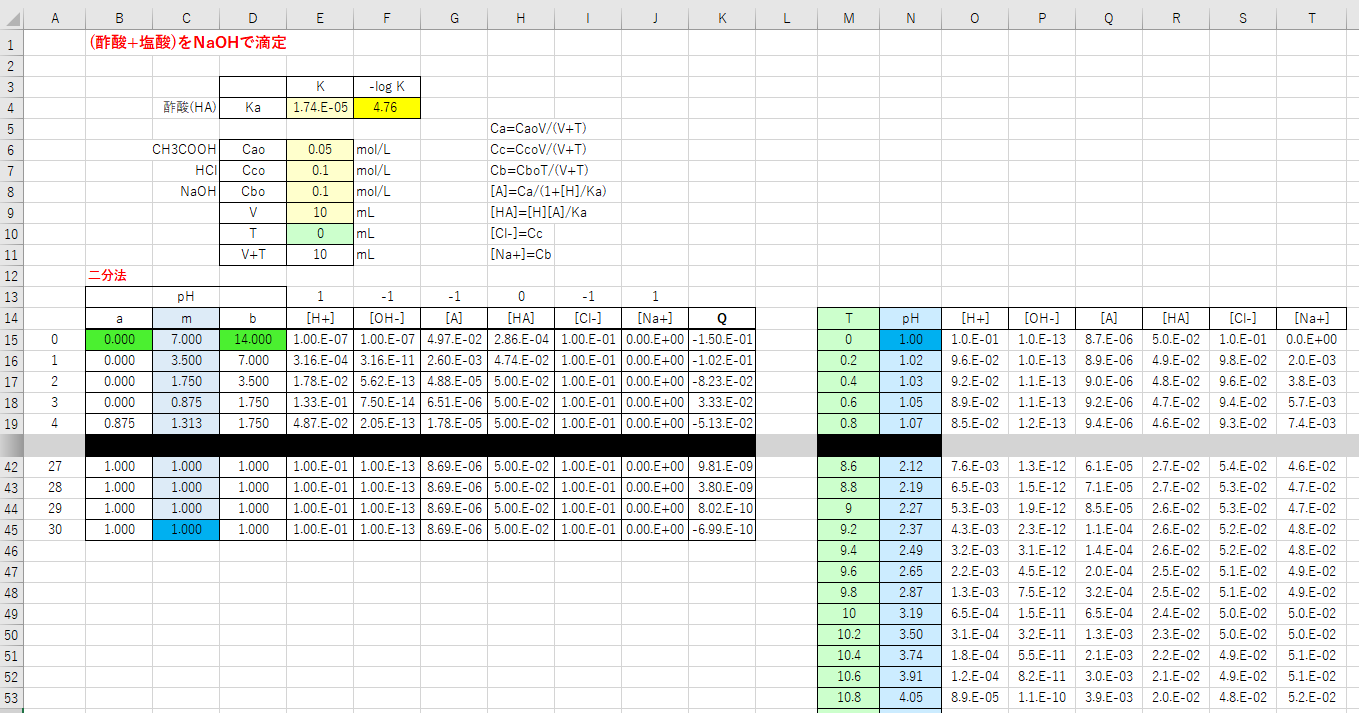



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




滴定の解説 イプロスモノシリ モノシリ 製造業技術用語集




沈殿滴定 水道水中の塩化物イオン ファヤンス法 モール法 Transblog




ミネラル サプリ キレート 滴定




京都電子工業株式会社




Jpa 硫酸アルミニウムの製造方法 Google Patents




17 号 可搬型滴定装置 Astamuse




炭酸塩ph標準液 Ph 10 01 Carbonate Ph Standard Solution Ph 10 01 037 詳細情報 分析 試薬 富士フイルム和光純薬




薄めたmcilvaine緩衝液 Ph 3 0 Diluted Mcilvaine Buffer Solution Ph 3 0 044 042 詳細情報 医薬品 製造 品質管理 分析 試薬 富士フイルム和光純薬




アプリの紹介 キレート滴定曲線 車輪の再発見みたいな
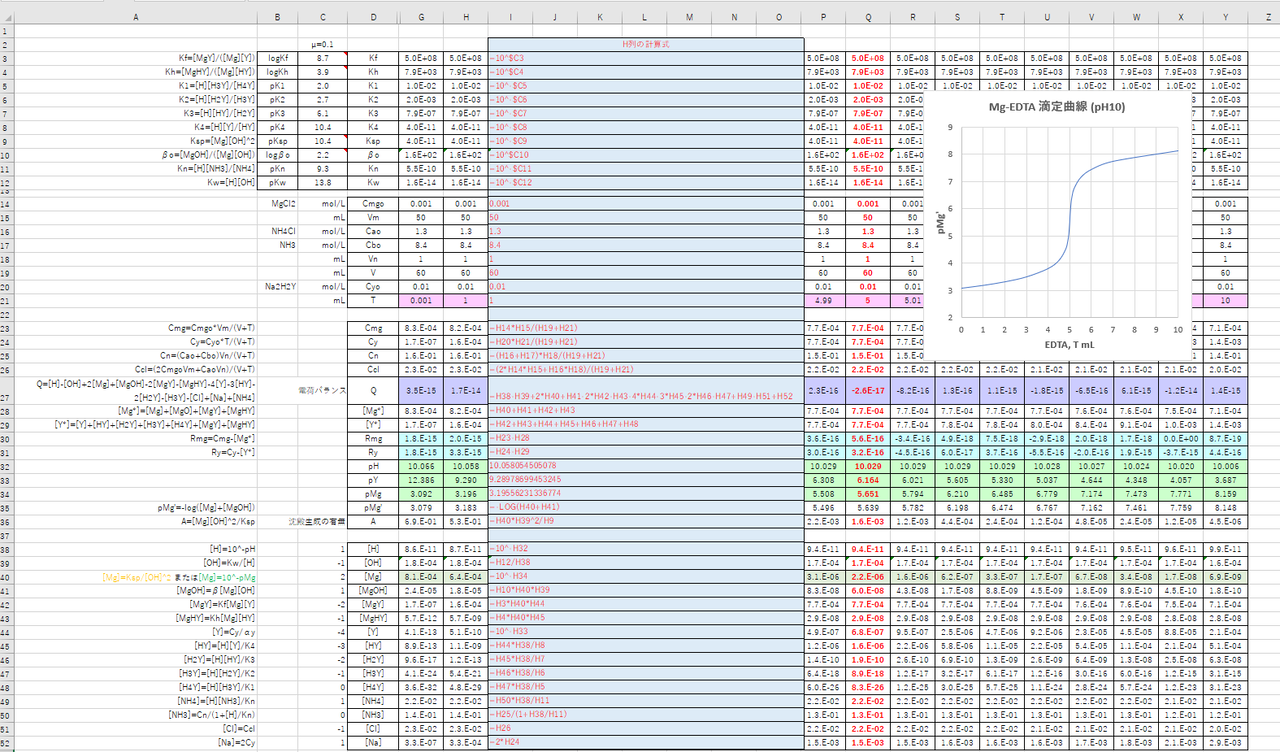



年05月 滴定曲線 溶解度などーエクセルを用いて




滴定の解説 イプロスモノシリ モノシリ 製造業技術用語集



クレゾールフタレイン Wikipedia



0 件のコメント:
コメントを投稿